Поверхностные явления в вакууме
На поверхности твёрдого тела обычно существует слой связанных молекул. Поглощение молекул твёрдым телом называется сорбцией, обратный процесс — десорбцией, а поглощающее тело — сорбентом. Эти явления имеют большое значение в вакуумной технике. Интенсивная десорбция приводит к обильному газовыделению и сильно замедляет откачку, наоборот, активная сорбция ведёт к быстрому поглощению газа и используется для откачки в специальных сорбционных насосах.
На поверхности системы может быть связано много большее число молекул по сравнению с числом молекул свободно летающих в объёме.
Адсорбированные молекулы находятся на поверхности в состоянии динамического равновесия, когда часть молекул в результате случайных процессов отрывается и уходит и столько же частиц за это время соударяется с поверхностью и вновь поглощается ею. При этом количество молекул на единице поверхности остаётся постоянным, оно зависит от давления, температуры и от свойства материала.
Явления, приводящие к поглощению молекул, различаются по природе. При физической адсорбции молекулы удерживаются на поверхности силами Ван-дер-Ваальса. Поверхностные силы кристаллической решётки не уравновешены с внешней стороны. Поэтому на поверхности существуют центры адсорбции с расстояниями порядка молекулярных размеров (10–8 см), а число поглощённых молекул пропорционально площади поверхности. Адсорбированные молекулы могут располагаться мономолекулярным слоем или в несколько слоёв. Адсорбированное состояние устойчиво и соответствует минимуму потенциальной энергии молекулы. Поэтому адсорбция сопровождается выделением энергии, которую можно характеризовать удельной теплотой адсорбции. Наоборот, нагревание сообщает молекулам добавочную энергию для преодоления потенциального барьера и приводит к десорбции.
Хемосорбция сопровождается образованием валентных связей молекул газа с поверхностью; некоторые реакции эндотермические, поэтому нагрев может, увеличит количество хемосорбированных молекул. Абсорбцией называют объёмное поглощение газов твёрдым телом, при этом возможны образование твёрдых растворов, объёмная хемосорбция и другие процессы.
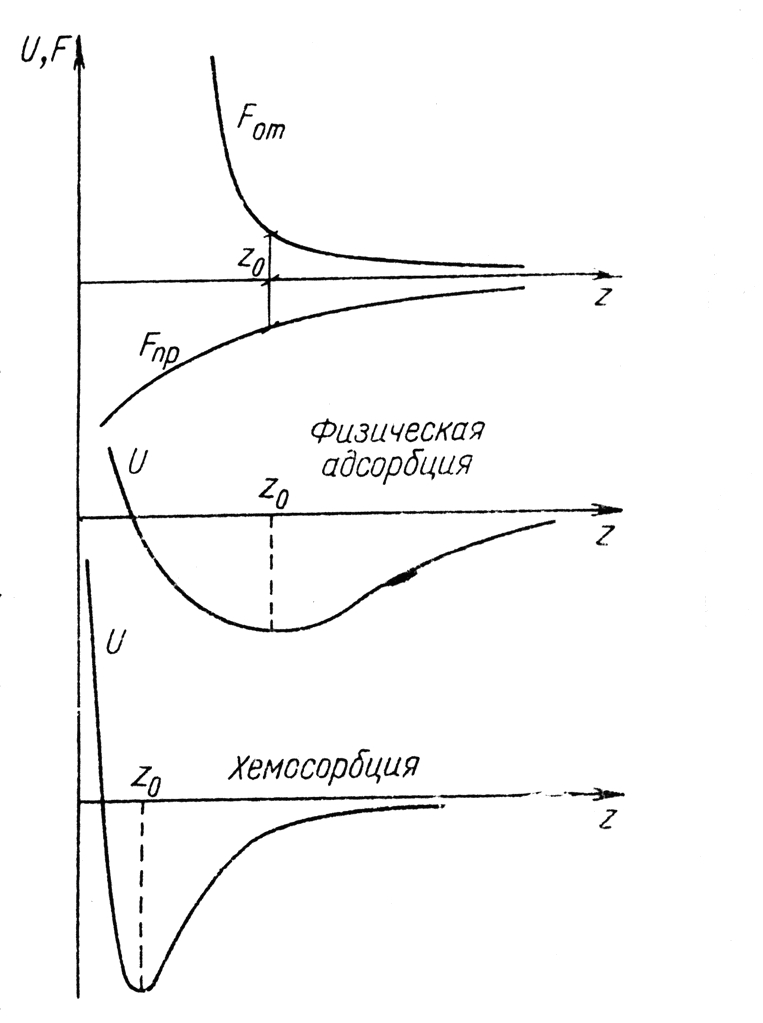
Рис. 1.8. Потенциальные ямы при адсорбции
Упрощённо можно считать, что вблизи поверхности существует сила притяжения Fпр и отталкивания Fот, причём последние уменьшаются быстрее с удалением от поверхности. На некотором расстоянии z0 силы, действующие на молекулу газа, уравновешиваются, при этом имеет место минимум потенциальной энергии 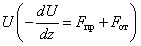 (рис. 1.8). Это равновесие обладает свойством устойчивости, так как при удалении молекулы (z > z0)протяжение преобладает (Fпр > Fот) и молекула приближается к z0. Наоборот, если молекула сместится от равновесия ближе к поверхности, от при z < z0 силы отталкивания (Fпр > Fот) вернут её назад к z0.
(рис. 1.8). Это равновесие обладает свойством устойчивости, так как при удалении молекулы (z > z0)протяжение преобладает (Fпр > Fот) и молекула приближается к z0. Наоборот, если молекула сместится от равновесия ближе к поверхности, от при z < z0 силы отталкивания (Fпр > Fот) вернут её назад к z0.
Физическую адсорбцию и хемосорбцию трудно различить, но при последней связь обычно более прочная. Условно считают, что при глубине потенциальной ямы менее 3–4 ккал/моль имеет место физическая адсорбция, при энергии связи свыше 8 ккал/моль — хемосорбция.
Изотермами адсорбции называют кривые, показывающие зависимость равновесного количества адсорбированного газа μ на единицу поверхности или массы сорбента от давления при различных температурах. Очевидно, μ должно возрастать с увеличением давления у поверхности и убывать с ростом температуры.
При испарении вещества в вакууме над нагретой поверхностью в ограниченном объёме накапливаются молекулы пара, его давление увеличивается и усиливается обратный процесс конденсации. Равновесное давление пара называют упругостью насыщенных паров. Это давление для данного вещества возрастает с температурой: чем больше температура, тем больше скорость испарения, тем больше давление необходимо, чтобы уравновесить его конденсацией. Удельная теплота испарения L= (T/lρ)×dP/dt кал/г, где l — механический эквивалент тепла; ρ — плотность пара. Экспериментально установлено, что величина L линейно убывает с температурой: L = L0– аТ. Используя ρ = Pm/kT, получим
После интегрирования имеем
Формула Клапейрона (1.55) описывает зависимость упругости насыщенных паров от температуры. Обычно её пишут в виде ln P = A – B/T, пренебрегая слабым членом с ln T.
Например, для вольфрама А = 12,24; B=4,026 ·10-2 , если давление выражено в торрах.
Упругость насыщенных паров обладают не только жидкости, но и твёрдые тела, так как испарение может происходить из твёрдой фазы. Упругость — это максимальное давление вещества при данной температуре. Пар в состоянии насыщения не подчиняется закону Бойля-Мариотта, сжатие его приводит к усилению конденсации при сохранении исходного давления, равного упругости паров. Высокое значение упругости может ограничить возможность получения вакуума. Например, наличие воды в системе не позволит понизить давление ниже 17,5 торр до полного испарения воды.
Упругости паров различных химических элементов в зависимости от температуры приведены в приложении.
