1.2.1. Химически самая инертная среда
Химическая инертность вакуума используется в электрических лампочках и в электронных лампах. И в тех и в других есть сильно нагретые металлические детали. В электрической лампочке это спираль. Если в лампочку попадет воздух, спираль мгновенно сгорает, а баллон покрывается белым налетом — окисью вольфрама (если воздух в лампочку попадает медленно, т. е. реакция идет не с избытком, а с недостатком газа, образуется другая окись вольфрама — голубого цвета). Заметим, что с точки зрения химической инертности небезразлично, молекулы каких газов остались в лампе. В первую очередь опасен кислород.
Оценим, какое давление кислорода может быть в лампочке, чтобы она служила не менее 1000 часов. При высоких температурах каждая молекула кислорода, попавшая на поверхность вольфрама, вступает с ним в химическое взаимодействие, а получившаяся в результате реакции молекула окиси вольфрама испаряется, открывая другим молекулам кислорода доступ к металлу. При окислении вольфрама нить становится тоньше, ее электрическое сопротивление увеличивается, потребляемая мощность, а вместе с нею и сила испускаемого света уменьшаются. Предположим, что допустимое уменьшение радиуса нити 5 мкм*). Слой вольфрама единичной площади и толщиной 5 мкм имеет массу около 100 г/м2 (при плотности вольфрама як 20 г/см3). На окисление одного атома вольфрама расходуются три атома кислорода, поэтому на окисление 5 мкм вольфрама пойдет
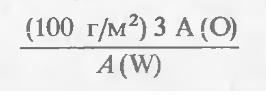
кислорода (где А (О) = 16 — атомная масса кислорода, A (W) = - 184 — атомная масса вольфрама), что составляет приблизительно 25 г/м2, или 5-1023 молекул/м2 (масса 6-1023 молекул кислорода равна 32 г).
При каком давлении воздуха за 1000 часов на единичную площадь поверхности вольфрама попадет 5 -1023 молекул/м2 кислорода? При атмосферном давлении (105 Па) концентрация молекул кислорода составляет

Приравняв тепловую энергию ЗкТ/2 молекулы кислорода средней кинетической энергии mv2/2, можем определить ее среднюю скорость (т — масса молекулы, &=1,38-10~23 Дж/К — постоянная Больцмана). После чего легко посчитать плотность потока молекул кислорода, падающего на поверхность вольфрама при давлении Р
*) При исходном диаметре проволоки, равном 0,1 мм, уменьшение ее радиуса на 5 мкм увеличит сопротивление проволоки и уменьшит потребляемую ею мощность примерно на 20%. Этот расчет вы легко проведете сами.
(Р/105) ■ 3 • 1025 • 500 = Р ■ 1,5 • 1023 молекулДм2 ■ с), где давление Р выражено в паскалях.≈
Таким образом, количество молекул, попадающих на поверхность металла за 1000 часов, составляет
Р -1,5 • 1023 ■ 1000 • 3600 «Р ■ 0,5 ■ 1030 молекул/м2.
Нам надо, чтобы это количество не превышало критического значения, равного 0,5 ■ 1024 молекул/м2, следовательно, давление кислорода в лампе не должно превышать значения Р = 10 -6 Па. Это ограничение накладывается на давление в лампе кислорода или иного газа, так же активно взаимодействующего с вольфрамом.
